Thomsons rosinbollemodell
Thomsons rosinbollemodell for atomets oppbygning ble foreslått av den engelske fysiker J.J. Thomson etter at han hadde oppdaget elektronet i 1897. Denne partikkelen ble nesten med en gang antatt å være bæreren av den negative elementærladningen som tidligere var påvist i elektrolyseeksperimenter. Målinger viste at elektronet hadde en masse som var av størrelsesorden en tusendel av massen av hydrogenionet, det som i dag kalles et proton.
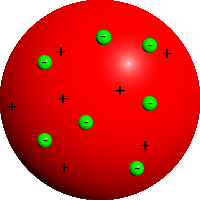
På den tiden begynte man å spekulere på om all materie var bygd opp av elektroner og at deres bevegelse inne i atomene kunne gi opphav til emisjon av lys med karakteristiske spektra. Allerede i 1895 hadde den nederlandske fysiker Hendrik Lorentz brukt en slik modell til å forklare hvordan spektrallinjene ble påvirket av magnetfelt. Et par år senere ble denne Zeeman-effekten nøyaktig målt av hans landsmann Pieter Zeeman. Resultat for forholdet e/m mellom ladning og masse for elektronet som Thomson fant, var i overensstemmelse med hva Zeeman hadde funnet. Dette bildet ble ytterligere styrket rundt 1900 da Rutherford viste at betastråling bestod av elektroner som ble antatt å komme ut fra atomene.
All denne nye innsikten medførte at Thomson og andre på samme tid begynte å forestille seg atomene som bestående av negativt ladde elektroner, holdt sammen av en ukjent kraft som samtidig måtte inneholde like mye positiv ladning for å gjøre atomet elektrisk nøytralt. Dette bildet ble først foreslått av Lord Kelvin i 1902.[1] Den positive ladningen kunne ikke bestå av positive enkeltladninger alene. Dette skyldes teoremet til Samuel Earnshaw som flere tiår tidligere hadde vist at et system bestående av positive og negative ladninger holdt sammen med Coulomb-krefter, ikke kunne være mekanisk stabilt.
En dynamisk ringmodell rediger
Thomson hadde flere år tidligere undersøkt forskjellige dynamiske systemer bestående av små magneter med magnetiske vekselvirkninger. Disse var i utgangspunktet også ustabile, men kunne gjøres stabile ved å arrangere magnetene på en sirkel i regelmessig avstand fra hverandre.[2] Dette fikk han til å tro at en tilsvarende plassering av elektronene i et atom kunne også gjøre det stabilt.[3]
Rent konkret tenkte Thomson seg at elektronene i befant seg i det elektriske potensialet fra en positiv ladningsfordeling med radius R som skulle være atomets radius. Inneholder det N elektroner, må den totale, positive ladningen være Ne for at atomet som helhet skulle være elektrisk nøytralt. Antas det så at denne er jevnt fordelt, vil det på et elektron virke en elektrisk kraft rettet innover mot sentrum til "rosinbollen" i avstand r med størrelse Ne2r/4πε0R3. Dette følger fra en kombinasjon av Coulombs lov og Gauss' lov. Men samtidig vil de andre N - 1 elektronene plassert regelmessig på sirkelen, gi en frastøtende Coulomb-kraft som virker i motsatt retning. Legges disse enkeltbidragene sammen, gir det nettokraften
hvor summen er bidraget fra de andre elektronene. Denne elektriske kraften må balanseres mot sentripetalkraften mv2/r hvor m er massen til elektronet og v er den felles hastighet for elektronene i ringen. Så lenge denne er slik at ligningen er oppfylt for en viss verdi av baneradius r, er elektronkonfigurasjonen i likevekt.
Det neste spørsmålet Thomson undersøkte, var stabiliteten til denne likevekten. For N < 6 elektroner i banen, var det ingen problemer hvis bare hastigheten v ble gjort stor nok. Men for N = 6 dukket det en ustabilitet opp. Den kunne han fjerne ved å plassere et ekstra elektron i sentrum av atomet. Det stabiliserte ringen. Mer generelt kunne han vise at en mindre ring innenfor en ytre ring virket stabiliserende. På den måten kom han frem til en modell bestående av konsentriske ringer i samme plan med økende antall elektroner i hver ring etter som man beveget seg utover. I denne modellen var de kjemiske egenskapene til atomet bestemt ved de innerste elektronene som derved avgjorde atomets valens.
Plasseringen av elektronene i ringer hadde også den store fordel at deres rotasjon rundt sentrum til bollen ville resultere i mindre utstråling av elektromagnetiske bølger og spesielt for lave rotasjonshastigheter. Thomson hadde i tidligere arbeid påvist denne effekten. Hvis det var så mange elektroner i en ring at de dannet en kontinuerlig og dermed konstant strøm, vil det ikke forekomme noen stråling i det hele tatt. Med et endelig antall elektroner i en ring, estimerte Thomson at det normalt ville ta så lang tid for elektroner å tape energi ved denne prosessen at man kunne se bort fra utstrålingen. Og skulle elektronene tross alt tape sin energi, kunne de frigjøres og gi en forklaring av den radioaktive betastrålingen som nettopp var oppdaget.
Det karakteristiske linjespekteret for atomet skulle skyldes at når det ble utsatt for en ytre påvirking eller det kolliderte med et annet atom, så vil elektronene svinge rundt sin likevektsposisjoner og dermed sende ut elektromagnetisk stråling. Fra den typiske bølgelengden for synlig lys, kan man da estimere utstrekningen av atomet til å være av størrelsesorden 0,1 nm. Dette stemmer med hva som ti år senere ble funnet i Rutherfords atommodell. Men ingen virkelig overbevisende, kvantitative resultat fulgte fra disse detaljerte, dynamiske beregningene.
Atomets masse rediger
På den tiden var det også uklart hvor mange elektroner det var i et atom. Men massen til atomet måtte være lik summen av massene til alle elektronene da det var antatt at det positive bindemiddelet som holdt dem på plass, var av en slik ukjent substans at det ikke bidro til massen. På den tiden ble elektronet antatt å være den eneste elementærpartikkel. Da hvert elektron hadde en tusendel av massen til et hydrogenatom, måtte derfor dette atomet ha omtrent tusen elektroner og større atomer mange titusen.
Men gradvis etter 1903 ble det klart at dette ikke kunne være riktig. Dette skyldes primært at Thomson hadde beregnet spredningstverrsnittet for røntgenstråling i forskjellige stoffer.[4]. Dette var direkte proporsjonalt med antall elektroner i hvert atom. Basert på målinger som hans medarbeider C.G. Barkla hadde gjennomført, kom man frem til at antall elektroner i atomet ikke kunne være mye større enn atomnummeret.[5][6] Dette ble også snart bekreftet av Thomsons egne beregninger av brytningsindeksen til gasser bestående av atomer beskrevet ved hans modell.[7] Etter 1906 var det da klart at massen til atomet måtte skyldes noe annet enn elektronene. Det mest nærliggende var at den var forbundet med den positive ladningen i atomet. I tillegg ville det nå være så få elektroner i ringene at utstrålingen fra dem ville bli mye større og dermed gjøre dem ustabile. Spesielt kritisk var det for hydrogenatomet som sannsynligvis bare inneholdt et elektron. Atommodellen til Thomson var derfor kommet opp i store vanskeligheter.
Midt opp i denne utviklingen mottok Thomson i 1906 Nobelprisen i fysikk for sin utforskning av elektriske ledning i gasser.[8] Det var denne innsatsen som hadde ført til oppdagelsen av elektronet. Thomson var fremdeles overbevist om sin modell for atomet og presenterte den i en lengre avhandling.[9]
Andre atommodeller rediger
En alternativ modell hadde blitt foreslått av den japanske fysiker H. Nagaoka i 1904. Han tenkte seg elektronene i baner rundt en sentral kjerne holdt på plass av den positive ladningen der.[10] Stabiliteten skulle skyldes samme mekanisme som gjør ringene rundt platen Saturn stabile, uten at denne var helt forstått. Men elektronene vil i denne modellen også sende elektromagnetisk stråling i sin gang rundt kjernen. Dermed vil de tape energi, falle inn mot kjernen og dermed gjøre atomet ustabilt. Dette var et større problem i denne modellen enn i Thomsons modell og bidro til at dette forslaget ikke fikk noen særlig betydning. Men samme bilde av atomet gjenoppsto ti år senere i Bohrs atommodell.
I 1909 begynte Rutherford og hans medarbeidere systematisk å utforske atomets struktur ved å benytte spredning av alfapartikler. Dette gullfolieeksperimentet viste at Thomson modell var helt feil. Den positive ladningen i atomet var konsentrert i en mye mindre, men meget tung atomkjerne med elektronene i baner utenfor. Få år senere brukte Niels Bohr denne Rutherfords atommodell som utgangspunkt for en ny og mer konkret modell hvor atomets stabilitet ble forklart ved den første bruk av en ny kvantemekanikk.
Referanser rediger
- ^ Lord Kelvin, Aepinus Atomized, Phil. Mag. 3, 769-781 (1902).
- ^ A. Pais, Inward Bound: Of Matter and Forces in the Physical World, Clarendon Press, Oxford (1986). ISBN 0-19-851971-0.
- ^ J. J. Thomson, (1904) On the structure of the atom. Arkivert 13. desember 2013 hos Wayback Machine., Phil. Mag. 7, 237-265 (1904).
- ^ J. J. Thomson, Conduction of electricity through gases, Cambridge University Press, Cambridge (1906).
- ^ C. G. Barkla, Secondary Radiation from Gases subject to X-Rays, Phil. Mag. 5, 685-698 (1903).
- ^ C. G. Barkla, Energy of Secondary Röntgen Radiation, Phil. Mag. 7, 543-560 (1904).
- ^ J.J. Thomson, On the Number of Corpuscles in an Atom, Phil. Mag. 11, 769-781 (1906).
- ^ J. J. Thomson, Nobel-foredrag, Stockholm (1906).
- ^ J. J. Thomson, The Corpusclar Theory of Matter, Constable & Co, Ltd., London (1907).
- ^ H. Nagaoka, Kinetics of a System of Particles illustrating the Line and the Band Spectrum and the Phenomena of Radioactivity, Phil. Mag. 7, 445 - 455 (1904).
Eksterne lenker rediger
- C. Baily, Early Atomic Models - From Mechanical to Quantum (1904-1913), arxiv.org-1208.5262.