Vandig løsning
Denne artikkelen trenger flere eller bedre referanser for verifikasjon. |
En vandig løsning er en løsning der løsningsmidlet er vann. Det vises for det meste i kjemiske ligninger ved å legge til (aq fra engelsk aqueous) til den aktuelle kjemiske formelen. For eksempel vil en løsning av bordsalt eller natriumklorid (NaCl) i vann bli representert som Na+(aq) + Cl-(aq). Siden vann er et utmerket løsningsmiddel og også er naturlig rikelig, er det et allestedsnærværende løsningsmiddel i kjemi. Vandig løsning er vann med en pH på 7,0 hvor hydrogenionene (H+) og hydroksidionene (OH−) er i Arrhenius-balanse (10−7).
| Vandig løsning | |||
|---|---|---|---|
| Kjemiske egenskaper |
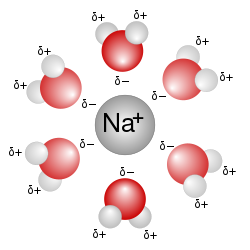
En ikke-vandig løsning er en løsning der løsningsmidlet er en væske, men ikke er vann.[1]
Stoffer som er hydrofobe ("vannfryktige") oppløses ikke godt i vann, mens de som er hydrofile ("vannvennlige") gjør det. Et eksempel på et hydrofilt stoff er natriumklorid. Syrer og baser er vandige løsninger, som en del av deres Arrhenius-definisjoner.
Et stoffs evne til å oppløses i vann bestemmes av om stoffet kan matche eller overstige de sterke tiltrekningskreftene som vannmolekyler genererer seg imellom. Hvis stoffet mangler evnen til å oppløses i vann, danner molekylene et bunnfall.
Vandige løsninger som leder elektrisk strøm effektivt inneholder sterke elektrolytter, mens de som leder dårlig anses å ha svake elektrolytter. Disse sterke elektrolyttene er stoffer som er fullstendig ionisert i vann, mens de svake elektrolyttene bare utviser en liten grad av ionisering i vann.
Ikke-elektrolytter er stoffer som oppløses i vann, men som opprettholder sin molekylære integritet (ikke dissosieres i ioner). Eksempler inkluderer sukker, urea og glyserol.
Når du skriver ligningene av vandige reaksjoner, er det viktig å bestemme bunnfallet. For å bestemme bunnfallet, må man se et diagram over løselighet. Oppløselige forbindelser er vandige, mens uoppløselige forbindelser er bunnfallet. Det vil ikke alltid oppstå et bunnfall.
Når man utfører beregninger angående reaksjon av en eller flere vandige oppløsninger, må man generelt kjenne konsentrasjonen eller molariteten til de vandige oppløsninger. Løsningskonsentrasjon er gitt i form av løsemidlet før den oppløses.
Referanser
rediger- ^ «Solutions». www.chemistry.wustl.edu. Besøkt 19. februar 2021.