Rydbergs formel
Rydbergs formel gir frekvensene for strålingen som kommer fra et atom som har bare et elektron i en ytre bane, når dette gjør et kvantesprang. Formelen ble funnet av den svenske fysikeren Johannes Rydberg i 1888 som en tilpassning til observerte bølgelengder i spektralseriene til alkalimetallene.[1]
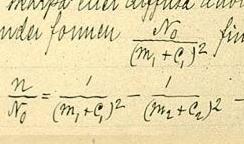
Et atom med ett eneste elektron i ytre bane, kalles et Rydberg-atom. Energien til elektronet er da nesten den samme som i et hydrogenatom gitt ved hovedkvantetallet n og det asimutale kvantetallet ℓ. Men når dette siste er lite, vil elektronet til dels befinne seg innenfor de andre elektronene og derved oppleve en sterkere tiltrekning mot atomkjernen. En slik tilstand vil derfor få noe lavere energi enn for en tilsvarende tilstand med de samme kvantetallene i et H-atom hvor det ikke er noen indre elektroner.
Ved å benytte formelen for energinvåene til H-atomet først beregnet i Bohrs atommodell, vil derfor med god nøyaktighet de tilsvarende energinivåene for et Rydberg-atom kunne skrives som
hvor R er Rydberg-konstanten, n er positive heltall og Δℓ er en «Rydberg-korreksjon», også kalt en kvantedefekt. For store verdier av kvantetallet ℓ befinner elektronet seg for det meste utenfor de indre elektronene, og denne korreksjonen blir derfor liten og neglisjerbar.
Frekvensen ν for en overgang mellom to slike tilstander med energier E og E' er da gitt ved Bohrs formel hν = E - E' slik at
hvor n = n' + 1, n' + 2, ..... Dette er Rydberg-formelen. Holdes ℓ og ℓ' konstant, definerer dette frekvensene en spektralserie. Overganger ℓ = 1 til ℓ = 0 kalles en «prinsipal serie» eller p-serie, mens ℓ = 0 til ℓ = 1 kalles en «skarp serie» eller s-serie. Tilsvarende tilhører overganger ℓ = 2 til ℓ = 1 en «diffus serie» eller d-serie og ℓ = 3 til ℓ = 2 omtales som en «fundamentale serie» eller f-serie. I eldre litteratur kalles denne ofte for en «Bargmann-serie» eller b-serie.
Når n → ∞, vil hν tilsvarer energien som trenges for å ionsere atomet når det befinner seg i tilstanden (n' ,ℓ'). Den tilsvarende frekvensen eller bølgelengden kalles for seriegrensen.
I et hydrogenatom er det bare ett elektron og derfor ingen kvantedefekter. Rydbergs formel går da over i Balmer-formelen. Denne ble først utledet i Bohrs atommodell, men følger også fra kvantemekanikken når man ser bort fra de mye mindre finstrukturkorreksjonene. Også når hovedkvantetallet for et elektron i et større atom er mye større enn kvantedefekten, går Rydberg-formelen over i Balmer-formelen. Det ytterste elektronet beveger seg da langt utenfor de andre elektrone i en bane som er nesten klassisk og formelen gir verdier for de emitterte frekvensene med stor nøyaktighet.
Alkalimetaller
rediger| ℓ | Li: n = 2 | Na: n = 3 | K: n = 4 | Rb: n = 5 | Cs: n = 6 |
|---|---|---|---|---|---|
| s | 0.40 | 1.35 | 2.19 | 3.13 | 4.06 |
| p | 0.04 | 0.85 | 1.71 | 2.66 | 3.59 |
| d | 0.00 | 0.01 | 0.25 | 1.34 | 2.46 |
| f | 0.00 | 0.00 | 0.00 | 0.01 | 0.02 |
Mens et elektron i et vilkårlig atom for store verdier av hovedkvantetallet befinner seg i en Rydberg-tilstand, gir denne beskrivelsen brukbar nøyaktighet for alkalimetallene til og med for de laveste tilstandene. I disse grunnstoffene er det ytterste eller optiske elektronet alene i en s-orbital i et nytt elektronskall som i stor grad ligger utenfor skallene som de indre elektronene befinner seg i. Kvantedefekten Δl avtar raskt med økende verdier for det asimutale kvantetallet l slik at Rydbergs formel da gir stadig bedre verdier for spektrallinjene.
Kvantedefektene kan bestemmes empirisk eller beregnes ved atomteoretiske metoder. Representative verdier er gitt i tabellen.[2] De er normert slik at elektronet i grunntilstanden for Li-atomet har n = 2, for Na-atomet har n = 3, etc. Verdiene i tabellen er for litt større verdier av hovedkvantetallet n > 5. Når n tar mindre verdier, øker defektene med et par prosent.
D-linjen i Na-spektret
redigerGrunntilstanden til Na-atomet er 3s. Den kraftig gule linjen i spektret oppstår ved en overgang fra 3p-tilstanden og blir benyttet i natriumlampen. I virkeligheten er dette energinivået splittet på grunn av spinn-banekoblingen, men denne finstrukturen ligger utenom nøyaktigheten til beskrivelsen her. Fra Rydberg-formelen er da bølgelengden gitt ved
Utregnet finnes da λ = 592 nm, mens den korrekte verdien er 589 nm. I denne overgangen er n' = n = 3 og resultatet er derfor følsomt for det siste sifferet i kvantedefektene. For overganger mellom høyereliggende nivå blir overensstemmelsen med målte verdier enda bedre.
Historisk bakgrunn
redigerPå 1880-tallet arbeidet Rydberg med å analysere bølgelengdene til spektrallinjene for alkalimetallene. De opptrådte i serier, og han prøvde å finne matematiske lovmessigheter for verdiene innen de forskjellige seriene. Han hadde da den lykke, eller intuisjon, at han betraktet verdiene for de inverse bølgelengdene 1/λ i stedet for selve bølgelengden. Dette kalles for bølgetallet, det vil si antall bølger per lengdeenhet. Innen en og samme serie med merkelappen s, hadde alle bølgelengdene verdier som med god nøyaktighet fulgte fra formelen
hvor heltallet n anga nummeret til spektrallinjen i serien eller termen. Mens størrelsene Cs og Δs hadde forskjellige verdier i forskjellige serier, var derimot R den samme i alle serier for samme grunnstoff. Ikke bare det, den viste seg etterhvert å være den samme for alle grunnstoff. Han hadde derfor oppdaget en universell konstant som snart fikk navnet Rydberg-konstanten.
Omtrent på samme tid hadde Johann Balmer funnet sin formel for de synlige bølgelengdene i lyset fra hydrogen. Den hadde samme struktur som Rydbergs formel, men med Δs = 0. Dette styrket Rydberg i hans overbevisning om sin egen formels riktighet. Med bølgelengdene fra Balmer-serien i H-atomet fant han da verdien RH = 1,0972×107 m-1 for sin nye konstant. Dette er meget tett opp til dagens verdi.
Konstanten Cs i formelen gir verdien til den korteste bølgelengden som opptrer i serien. Den tilsvarer seriegrensen og kommer frem når n → ∞. Nå gjorde Rydberg også den oppdagelsen at noen ganger kunne denne seriegrensen uttrykkes ved en term i en annen serie. For eksempel, for natrium så er Cs = R/(3 - Δp)2 som er første term i dets p-serie. Videre kunne han påvise at andre kombinasjoner av termer fra forskjellige serier ga verdier for spektrallinjer som viste seg virkelig å finnes i spektret. På den måten kom han frem til sin generelle formel
for alle bølgelengdene som kan opptre i spektralseriene. Denne muligheten til å kombinere forskjellige termer for å finne nye bølgelenger, ble senere generalisert og kalles nå for Rydberg-Ritz' kombinasjonsprinsipp. I dag er det forstått som en direkte konsekvens av Bohrs lov hν = E - E' for frekvensene som vil opptre ved forskjellige kvantesprang i atomet.
Referanser
rediger- ^ J.R. Rydberg, Recherches sur la constitution des spectres d'emission des elements chimique, Den Kungliga Svenska Vetenskapsakademiens Handlingar 23 (11), (1889).
- ^ C.E. Burkhardt and J.J. Leventhal, Topics in Atomic Physics, Springer, New York (2005). ISBN 0-387-25748-9.

