Markovnikovs regel
I organisk kjemi er Markovnikovs regel eller Markownikoffs regel en observasjon av addisjonsreaksjoner mellom hydrogenforbindelser og umettede forbindelser, for eksempel alkener, basert på Zaitsevs regel. Den ble formulert av den russiske kjemikeren Vladimir Markovnikov i 1869.[1][2]
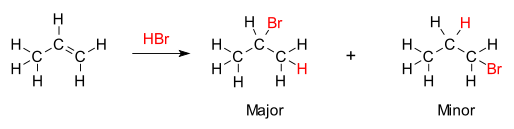
Regelen sier at ved addisjonen av en protisk syre HX til et alken, vil hydrogenatomet (H) i syren feste seg til det karbonatomet ved dobbeltbindingen som allerede har færrest alkylsubstituenter knyttet til seg og halidgruppen (X) vil gå til det karbonatomet som har flest alkylsubstituenter.[3][4] Det samme gjelder når et alken reagerer med vann i en addisjonsreaksjon og gir alkohol. Hydroksylgruppen (OH) binder seg til karbonet som har flest karbon-karbon-bindinger, mens hydrogenatomet binder seg til karbonatomet på den andre siden av dobbeltbindingen, karbonatomet med flest karbon-hydrogen-bindinger.
Mekanisme
redigerRegelen anvendes for å avgjøre hva som blir de viktigste reaksjonsproduktene ved en addisjonsreaksjon mellom to asymmetriske molekyler, hvorav det ene inneholder en karbon-karbon-dobbeltbinding og det andre har en elektropositiv og en elektronegativ del. Under reaksjonen åpnes dobbeltbindingen og ifølge Markovnikovs regel binder dermed den elektropositive delen til det karbonatomet i dobbeltbindingen som har flest hydrogenatomer bundet til seg, mens den elektronegative delen binder seg til det andre karbonatomet. Regelen stemmer godt med virkeligheten så lenge dobbeltbindingen ikke er i nærheten av sterkt elektrontiltrekkende substituenter. Det andre mulige addisjonsproduktet, med den elektronegative og elektropositive delen på motsatte karbonatomer, pleier vanligvis å dannes i langt mindre mengder. Når begge C-atomene i dobbeltbindingen har den samme graden av substitusjon, dannes det en blanding av addisjonsprodukter.
En mer generell forklaring på hvilket produkt som foretrekkes, krever en analyse av reaksjonsmekanismen. Den typen reaksjoner som Markovnikovs regel omhandler innledes med at den elektropositive delen (elektrofilen) angriper dobbeltbindingen slik at et karbokation dannes. Det kjemiske grunnlaget for Markovnikovs regel er dannelse av det mest stabile karbokationet under addisjonen. Addisjonen av H-atomet (i form av et proton) til et karbonatom i alkenet skaper en positiv ladning på det andre karbonatomet og gir et intermediat i form av et karbokation. Jo mer substituert karbokation (jo flere bindinger det har til karbon eller til elektrondonerende substituenter), desto mer stabilt er det på grunn av induksjon og hyperkonjugasjon. Resonans av nærliggende C-C-dobbeltbindinger virker også stabiliserende, mens nærliggende elektrontiltrekkende substituenter virker destabiliserende. Det største produktet (i prosentandel av samlede produkter) fra addisjonsreaksjonen vil være det som kommer fra det mest stabile intermediatet. Hovedproduktet fra addisjon av HX (hvor X er et mer elektronegativt atom enn H) til et alken har derfor H-atomet i den minst substituerte posisjonen og X i den mer substituerte posisjonen. Imidlertid vil det andre mindre substituerte, mindre stabile karbokationet også bli dannet til en viss grad. Dette intermediatet vil fortsette å reagere og gi det andre produktet med X bundet til karbonatomet på motsatt side av dobbeltbindingen.
Regelen kan oppsummeres som «den rike blir rikere»: i mange organiske addisjonsreaksjoner vil et karbonatom rikt på substituenter få flere substituenter og karbonatomet med flest hydrogenatomer bundet til seg vil få hydrogenatomet. Siden karbokationer er involvert som intermediater i disse elektrofile addisjonsreaksjonene, kan Markovnikovs regel omformuleres til: i addisjonen av HX til et alken, dannes det mer substituerte karbokationet som intermediat fremfor det mindre substituerte.[5]
Anti-Markovnikov-regelen
redigerMekanismer som unngår karbokation-intermediatet kan reagere ved hjelp av andre mekanismer som er regioselektive, mot hva Markovnikovs regel forutsier, slik som fri radikal-addisjon. Slike reaksjoner sies å være anti-Markovnikov siden halogenatomet adderer til det minst substituerte, det helt motsatte av Markovnikovs reaksjon. Akkurat som tilfellet for positiv ladning, er radikalet i sin mest stabile tilstand når det er i den mer substituerte posisjonen.
Anti-Markovnikov-mekanismen omfatter ikke bare addisjonsreaksjoner med alkener, men også andre kjemiske reaksjoner. En anti-Markovnikov manifestasjon er observert i den gullkatalyserte hydreringen av fenylacetylen som gir vanlig acetofenon, men som med en spesiell ruthenium-katalysator[6] gir den andre strukturisomeren 2-fenylacetaldehyd:[7]
Anti-Markovnikov-oppførsel kan også observeres i visse omleiringsreaksjoner. I en titan(IV)klorid-katalysert formell nukleofil substitusjon med enantiopure 1 i figuren under, dannes to racemiske produkter 2a og 2b:[8]
Denne produktfordelingen kan rasjonaliseres ved å anta at tap av hydroksylgruppen i 1 gir det tertiære karbokationet A som omgrupperer seg til det tilsynelatende mindre aktive sekundære karbokationet B. Klor kan komme til dette senteret fra to sider, noe som fører til den observerte blandingen av isomere. Et annet kjent eksempel på anti-Markovnikov-addisjon er hydroborering.
Referanser
rediger- ^ W. Markownikoff (1870). «Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren». Annalen der Pharmacie. 153 (1): 228–259. doi:10.1002/jlac.18701530204.
- ^ Was Markovnikov’s Rule an Inspired Guess? Peter Hughes 1152 Journal of Chemical Education • Vol. 83 No. 8. august 2006
- ^ «Additions to Alkenes: Regiochemistry». Arkivert fra originalen 19. februar 2020. Besøkt 14. juni 2011.
- ^ Organic Chemistry, 6. utgave, av John McMurry. Kapittel 6.9, s. 187
- ^ John McMurry (2010). Organic Chemistry With Biological Applications (engelsk) (andre utg.). Brooks/Cole. s. 230-231. ISBN 978-0-495-39147-0.
- ^ Katalysatorsystem basert på in-situ reaksjon mellom ruthenocen og Cp og naftalen-ligander, samt en annen stor pyridin-ligand.
- ^ Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal AlkynesAurélie Labonne, Thomas Kribber, and Lukas Hintermann Organic Letters; 2006; 8(25) s. 5853-5856; (Letter) doi:10.1021/ol062455k
- ^ TiCl4 Induced Anti-Markovnikov Rearrangement Mugio Nishizawa, Yumiko Asai, and Hiroshi Imagawa Organic Letters; 2006; 8(25) s. 5793-5796; (Letter) doi:10.1021/ol062337x.
Eksterne lenker
rediger- Khan Academy lecture (læringsvideo)