Kjemisk forbindelse
En kjemisk forbindelse er en ren kjemisk substans som består av to eller flere ulike kjemiske elementer[1][2] som kan bli separert til enklere substanser ved kjemiske reaksjoner.[3] Kjemiske forbindelser dannes når to eller flere ulike atomer binder seg sammen og blir til ett. Atomene binder seg sammen til molekyler og ioneforbindelser. Eksempler på slike kjemiske forbindelser er: hydrogenklorid (HCl), natriumklorid (NaCl), polyvinylklorid (PVC). En kjemisk forbindelse har helt andre egenskaper enn de grunnstoffene den kan være dannet av.
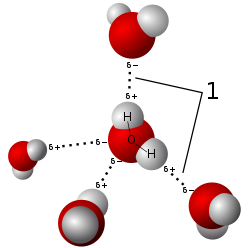
Kjemiske sammensetninger har en unik og definert kjemisk struktur; de består av et bestemt antall atomer[4] som er holdt sammen i en definert romlig anordning av kjemiske forbindelser. Kjemiske bindinger kan være molekylære forbindelser holdt sammen av kovalent binding, salter holdes sammen av ioniske sammensetninger, intermetallisk forbindelser holdes sammen av metalliske sammensetninger, eller komplekser holdt sammen av sideordnede kovalente forbindelser. Grunnstoffer er ikke betraktet som kjemiske forbindelser, selv om de består av molekyler som kan inneholde flerfoldige atomer av et enkelt element (eksempelvis H2, S8, etc),[5] noe som er kalt for diatomiske molekyler eller fleratomige molekyler.
Åtteregelen
redigerKjemiske forbindelser blir i noen tilfeller dannet av «oktettregelen». Åtteregelen er at alle atomene vil ha 8 elektroner i ytterste skall, slik at de blir fullkommen. Unntaket er litium, det vil kvitte seg med det ytterste elektronet for å få fullt skall innerst der det kun kan være 2 elektron.
Elektronpar
redigerStoffene i hovedgruppe 1 og 2 vil lett reagere med hverandre, etter som at de utligner hverandre på elektronpar. Dette kalles elektronpar-binding. Stoffene har 1 til 4 felles elektron som går i bane i begge atomenes ytre skall.
Bindinger
redigerMan har forskjellige typer av kjemiske bindinger; metallbinding, ionebinding og kovalent binding.
- Metallbindinger: Periodesystemet kan deles mellom metaller og ikke-metaller. Metallbindinger oppstår mellom metallatomer, eksempelvis kobber (Cu), jern (Fe), sølv (Ag).
- Ionebindinger: Et ion får man når et atom gir fra seg et eller flere elektroner eller når et atom mottar et eller flere elektroner. Et atom som gir fra seg elektroner får en positiv ladning (ioneladning), og et atom som mottar elektroner får en negativ ladning (ioneladning). Størrelsen på denne ladningen er avhengig av hvor mange elektroner som blir avgitt/mottatt. Ioneforbindelser skjer mellom metaller og ikke-metaller. Et eksempel på en ioneforbindelse er natrium Na som reagerer med klor Cl. Natrium-atomet har et elektron i ytterste skall, når dette elektronet blir avgitt går natrium-atomet over til å bli et positivt natrium-ion, Na+. Klor-atomet har sju elektroner i ytterste skall og tar derfor imot dette elektronet, klor-atomet får nå åtte elektroner i ytterste skall og går over til å bli et negativt klor-ion, Cl-. Nå har man et positivt og et negativt ion, disse har en tiltrekning på hverandre og danner altså det som kalles en ionebinding, Na+Cl-, som er et salt.
- Kovalente bindinger: Når to eller flere ikke-metalliske atomer danner en forbindelse der de deler på elektroner får man det som kalles en kovalent binding, også kalt elektron-par-binding. Man har f. eks. vannmolekylet der to hydrogen-atomer H og et oksygen-atom O inngår. Oksygen-atomet har seks elektroner i ytterste skall, mens hydrogen-atomene har et elektron hver. Når da disse tre atomene danner en forbindelse forestiller vi oss at de deler alle elektronene (tilsammen åtte), men man får ikke en fullstendig overføring av elektroner til et av atomene slik man får i en ioneforbindelse. Derav navnet elektron-par-binding. Kovalentebindinger/elektron-par-bindinger danner det man kaller molekyler.
Referanser
rediger- ^ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2009): Chemistry: The Central Science, AP Edition (11. utg.), Paramus, NJ: Savvas Learning Company, ISBN 0-13-236489-1. s. 5–6
- ^ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005): General Chemistry (4. utg.), Paramus, NJ: Savvas Learning Company, ISBN 978-0-13-140283-6. s. 6
- ^ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002): Chemistry (1. utg.), Paramus, NJ: Savvas Learning Company, ISBN 0-13-251210-6. s. 36
- ^ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000): General Chemistry (6. utg.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, ISBN 978-0-03-072373-5. s. 15
- ^ Halal, John (2008): «Chapter 8: General Chemistry» (PDF) i: Milady's Hair Structure and Chemistry Simplified (5. utg.), Milady Publishing, ISBN 1-4283-3558-7. s. 96–98
Eksterne lenker
rediger- (en) Chemical compounds – kategori av bilder, video eller lyd på Commons