Hemoglobin
Hemoglobin (Hb) er et protein som finnes i store mengder i blodet og er en essensiell del av mekanismene som frakter oksygen med blodstrømmen i mennesket og andre vertebrater. Hemoglobinet binder oksygen sterkt i oksygenrike miljø, som i blodårene rundt lungene. I relativt oksygenfattige miljø frigis oksygenet til bruk i cellenes forbrenningssystem (Cellulær respirasjon). Hemoglobin finnes i store mengder i de røde blodlegemene, og er årsaken til blodets røde farge. Hemoglobinet trenger et jern-ion (Fe2+) for å binde oksygen. For lavt inntak av jern fører til at de røde blodlegemene får nedsatt evne til å transportere oksygen, og gir symptomer på jernmangel. Hemoglobin er også involvert i noen genetisk betingede sykdommer. Enkelte typer gassforgiftning oppstår fordi gasser som kullos og cyanid binder sterkere til hemoglobin enn oksygen, og slik hindrer oksygen i å bli fraktet med blodstrømmen. Hvert enkelt hemoglobin kan bære maksimalt fire oksygenmolekyler.
Introduksjon rediger
Hemoglobin har vært gjenstand for utstrakt forskning helt siden 1800-tallet, og har bragt viktige lærdommer om både oksygen-bindene protein og proteiner generelt. Max Perutz og John Kendrew delte i 1962 Nobelprisen i kjemi for banebrytende arbeid med dette proteinet. Hemoglobinets rolle er å frakte oksygen til, og karbondioksid fra cellene i organismen, hvor cellenes respirasjon konsumerer oksygen og produserer karbondioksid.
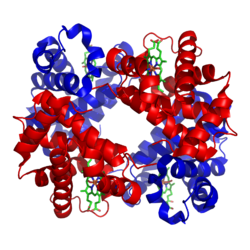
Hemoglobinets struktur er et klassisk eksempel på kompleks proteinstruktur, og involverer fire polypeptidkjeder med en kofaktor som består av hem (prostetisk gruppe) og jern (metall). Mange av mekanismene som forklarer hvordan hemoglobinet fungerer er generelle mekanismer som går igjen i beskrivelsen av mange andre proteiner, og hemoglobinet benyttes ofte som illustrerende eksempel da dette er særlig grundig studert.
Selv om eksemplene i denne teksten i stor grad tar utgangspunkt i pattedyr som puster med lunger, slik som mennesket, vil hemoglobinets rolle i organismer med gjeller for det meste være tilsvarende.
Struktur og mekanisme rediger
Hemoglobinet består av fire subenheter (polypeptidkjeder), hvorav to og to er like. Hver av subenhetene har en prostetisk gruppe som kalles hem, og til hver av hemgruppene er det bundet et jern-ion, som kan ha ladningen 2+ eller 3+. Imidlertid kan sistnevnte ladning, som finnes i såkalte methemoglobin-molekyler, ikke bindes til oksygen. Det er den jern-ladede hemgruppen som binder til oksygenet, så et hemoglobin kan altså frakte inntil fire oksygen-molekyler.
Binding av oksygen rediger
Etterhvert som oksygen binder til de forskjellige subenhetene endres hemoglobinets affinitet for oksygen. Det vil si at bindingen til oksygen er sterk når alle subenhetene er bundet til oksygen, mens oksygenet slipper lettere når kun noen eller ingen av subenhetene bærer oksygen. Den andre viktige faktoren som avgjør om oksygen bindes til hemoglobin eller ikke, er konsentrasjonen av oksygen i miljøet. Siden hemoglobinet har mindre evne til å binde oksygen når det er tomt for oksygen, er det avhengig av høye oksygenkonsentrasjoner for å bli bundet til oksygen. Motsatt vil det holde på bundet oksygen til oksygenkonsentrasjonen i miljøet er blitt relativt lav. Slik vil hemoglobinet på sin vandring med blodstrømmen i stor grad forbli ubundet til det kommer til oksygenrike miljø som årene rundt lungene. Når det så fraktes fra oksygenrike omgivelser vil det holde på oksygenet til det kommer til oksygenfattige miljø som årene i oksygentrengende vev. Denne evnen til å tilpasse hvor lett proteinet binder oksygen avhengig av hvor i blodstrømmen det befinner seg er essensiell for at hemoglobinet skal kunne fungere som transportmolekyl. Andre oksygenbindende proteiner som for eksempel myoglobin, som nyttiggjøres til å lagre oksygen i vev, har ikke denne evnen. Siden sannsynligheten for at en subenhet binder et oksygen henger sammen med sannsynligheten for at de andre subenhetene gjør tilsvarende binding, kalles dette for en kooperativ binding.
Konformasjonsendring rediger
Bakgrunnen for den kooperative bindingen beskrevet over, er at bindingen til oksygen forårsaker endringer i hvordan de forskjellige subenhetene er posisjonert i forhold til hverandre og sine hemgrupper. Hemoglobinet eksemplifiserer med dette at undersøkelser av proteinenes bevegelighet (dynamikk), og ikke bare struktur, er nødvendig for å forstå hvordan de fungerer. Modellen i figuren viser hvordan binding av oksygen fører til at proteinet antar en annen konformasjon. Det vil si at proteinets bestanddeler endrer posisjon i forhold til hverandre. Når oksygen bindes til jernionet på hemgruppen endres jernets egenskaper tilstrekkelig til at dette også kan bindes til aminosyren histidin, på subenheten som hemruppen er festet til. Dette fører til at histidin og hemgruppen trekkes i mot hverandre, og bevegelsen forplanter seg langs subenheten ettersom histidinet er en del av denne. Grovt sett kan man si at hemoglobinet, ved binding til oksygen, går i fra en ubundet konformasjon (deoxy-konformasjon) til en bundet konformasjon (oxy-konformasjon). Deoxy-konformasjonen har altså lavere affinitet for oksygen enn oxy-konformasjonen.
Regulerende binding av andre molekyler rediger
Hemoglobinet har imidlertid også andre mekanismer for å besørge at oksygen bindes og frigis på rett sted. Blant annet påvirkes hemoglobinets evne til å binde oksygen av et molekyl kalt BPG (2,3-bisfosforglyserat). BPG binder hemoglobinet på steder relativt langt unna der oksygen binder. Når binding til en del av proteinet påvirker bindingsegenskapene til en helt annen del av proteinet kalles det allosterisk binding. Dette er nok en generell mekanisme i proteiner som hemoglobinet gir en god illustrasjon på. Bindingen av BPG nyttiggjøres når et menneske eller annen organisme med hemoglobin i blodet introduseres for lavere oksygenkonsentrasjoner eller lavere oksygentrykk. Dette kan for eksempel skje ved opphold i høyfjell. I løpet av noen timer vil BPG-konsentrasjonen i blodet ha steget og vesentlig forbedre hemoglobinets evne til å frigjøre oksygen i vev. Det må understrekes at det også finnes flere andre molekyler og ioner som påvirker hemoglobinets affinitet for oksygen ved allosterisk binding.
Transport av andre molekyler enn oksygen rediger
Noen av de regulerende bindingene som hjelper hemoglobinet med å ha svakere affinitet for oksygen i oksygenfattige miljø involverer at karbondioksid fra miljøet bindes til hemoglobinet. Når hemoglobinet igjen når det oksygenrike miljøet nært lungene og binder oksygen vil karbondioksidet frigis. Karbondioksid forlater så organismen via åndedrettet. Slik fungerer hemoglobin også som et transportmolekyl for karbondioksid. Hemoglobinet forsyner altså cellenes forbrenningsystem med oksygen som trengs for å produsere energi, samtidig som det frakter karbondioksid, et avfallstoff fra den samme forbrenningen, ut av kroppen.
Helse rediger
Ettersom hemoglobin har en så sentral og essensiell funksjon i mennesker er det et særdeles interessant protein fra et medisinsk ståsted. I tillegg til at dysfunksjonelt protein er årsak til en del sykdommer, brukes hemoglobin også til å diagnostisere sykdommer som det ikke nødvendigvis er årsak til.
Dysfunksjonelt hemoglobin rediger
Dysfunksjonelt hemoglobin har naturlig nok store konsekvenser for organismen. Som eksempler på vanlige sykdommer hos mennesker kan nevnes anemi eller blodmangel som kan ha sin årsak i at det produseres for lite hemoglobin eller at hemoglobinet forsynes med for lite jern. Forskjellige genetiske defeketer kan forårsake at hemoglobinet ikke fungerer optimalt og gir alvorlige og kroniske symptomer.
Hemoglobin i diagnose rediger
Glykosylert hemoglobin er hemoglobin med et glukosemolekyl som del av ringstrukturen. Når blodsukkeret er høyt, vil en større andel av nydannede hemoglobinmolekyler inneholde glukose. Dette gir grunnlaget for analysen HbA1c som også betegnes som «langtidsblodsukker», og er en vanlig test for diabetes-pasienter. Denne testen foretrekkes fremfor å måle blodsukkeret direkte, da blodsukker-nivået svinger veldig, og en pålitelig diagnose vil kreve mange prøver. Bindingen av glukose til hemoglobin er imidlertid irreversibel, og reflekterer blodsukkernivået på det tidspunktet det enkelte hemoglobin-komplekset ble syntetisert. Informasjon om hvor stor andel av hemoglobinmolekylene som er bundet til glukose gir slik et bilde av blodsukkeret over tid. Det er normalt dette tallet man får oppgitt ved HbA1c-måling, ikke gjennomsnittlig blodsukkerverdi. En oppgitt HbA1c på f. eks. 10 % tilsvarer et gjennomsnittlig blodsukker på 15 mmol/L[1]
Når hemoglobin brytes ned, dannes mindre molekyler som bilirubin og urobilinogen. Nedbrytningsproduktene gir blåfarge, gulfarge og grønnfarge som kan sees ved blødninger under huden, blåmerker. De danner den grønne fargen i gallen, den brune fargen i avføring og gulfargen i urin.
Forgiftning rediger
Gasser som kullos og cyanid-gasser binder hemoglobinet mange ganger sterkere enn oksygen. Inntak av slike gasser fører derfor til at oksygentransporten blir blokkert eller lite effektiv. Slik forgiftning virker hurtig og forårsaker bevisstløshet og hjertestans etter kort tid. Ved lavere konsentrasjoner vil pasienten oppleve slapphet, svimmelhet og kan oppleve det tungt å puste.
Referanser rediger
- ^ Nathan DM, Kuenen J, Borg R, Zheng H, Schoenfeld D, Heine RJ (2008). «Translating the A1C assay into estimated average glucose values.». Diabetes Care. 31 (88): 1473–8. PMC 2742903 . PMID 18540046. doi:10.2337/dc08-0545.
Litteratur rediger
- Nelson, David L. & Cox Michael M. (2005). Lehninger Principles of Biochemistry (4 utg.). New York: W. H. Freeman and Company. s. 157-174. ISBN 0-7167-4339-6.