Klorat
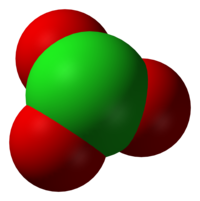
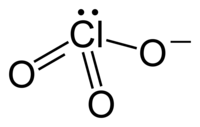
Klorat-ionet har den kjemiske formelen ClO3-. Klorat-ionet har en pyramideformet struktur. Klorat blir også brukt som fellesbetegnelse for kjemiske forbindelser som inneholder ett eller flere klorat-ioner, med klor i oksidasjonstilstanden +5. Klorater er salter
Framstilling rediger
Metallklorater kan bli framstilt ved å tilsette klorgass til varme metallhydroksider, f.eks. kan kaliumklorat (KClO3) bli tilvirket slik:
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
I industriell skala blir natriumklorat ( ) framstilt med basis i natriumklorid ( ) ved elektrolyse av en mettet vannoppløsning med natriumklorid som holder en temperatur på 40-60°C. En mere utførlig beskrivelse av produksjonsprosessen er forklart på siden for natriumklorat.
Egenskaper rediger
Klorater er meget kraftige oksidasjonsmidler og må holdes adskilt fra organiske stoffer og lett oksiderbare stoffer. Enkelte klorater kan uten forvarsel eksplodere i kontakt med slike stoffer, spesielt med svovel og sulfider.
Bruksområder rediger
Klorater ble tidligere benyttet i utstrakt grad i pyroteknikk, sprengstoff, fyrverkeri og fyrstikker. Bruken på disse områdene har imidlertid avtatt i senere tid på grunn av kloratenes ustabilitet, spesielt i blandinger med svovel og sulfider. I de fleste pyrotekniske innretningene er kloratene erstattet av perklorater ( ). Klorater blir også benyttet i ugressmidler og som blekemiddel i treforedlingsindustrien.
Noen kjente kloratforbindelser rediger
- Ammoniumklorat (NH4ClO3)
- Bariumklorat (Ba(ClO3)2)
- Kaliumklorat (KaClO3)
- Kalsiumklorat (Ca(ClO3)2)
- Magnesiumklorat (Mg(ClO3)2)
- Natriumklorat (NaClO3)
- Sinkklorat (Zn(ClO3)2)
- Sølvklorat (AgClO3)
- Se også: Klorsyre